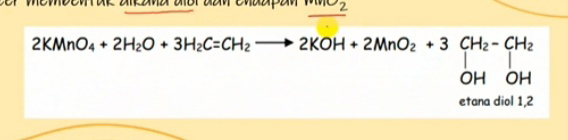
PEMBENTUKAN DAN SIFAT-SIFAT ASAM KARBOKSILAT

Baiklah kali ini kita akan membahas tentang pembentukan dan sifat-sifat dari asam karboksilat!!! Sebelum itu apa itu asam karboksilat??? Asam karboksilat adalah senyawa organic yang mempunyai gugus karboksil (-COOH) di dalamnya yang tergabung dari gugus hidroksil (-OH) dan melekat pada gugus karbonil (C=O). Asam karbosilat merupakan asam yang mudah ditemui. Sifat kimia asam karboksilat -Asam karboksilat bersifat polar karena ada gugus karboksil -Asam karboksilat merupakan asam lemah, semakin panjang rantai karbon maka makin lemah asamnya Sifat fisik asam karboksilat -Dua molekul asam karboksilat akan saling terhubung membentuk 2 ikatan hydrogen yang kuat sebagai dimer -Karena kuatnya ikatan tersebut, asam karboksilat di jumpai dalam bentuk dimer lingkar bahkan dalam fase uapnya. Dan ikatan hidogen ini sangat sulit putus walaupun pada fase uap tersebut -Ikatan hydrogen yang kuat menyebabkan asam karboksilat memiliki titik didih lebih tingg...