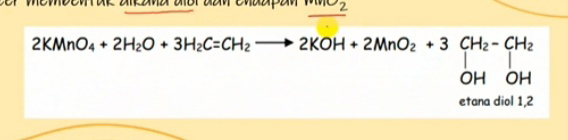
Sebelumnya kita sudah membahas reaksi oksidasi, selanjutnya kita akan membahas reaksi reduksi yang merupakan reaksi kebalikan dari oksidasi artinya terjadinya kehilangan gugus oksigen atau bertambahnya jumlah ikatan C-H. Jadi dalam reaksi reduksi pada senyawa organic ini bisa saja ikatan C-H nya bertambah dan ikatan C-O nya tetap atau ikatan C-H nya yang tetap atau ikatan C-O nya berkurang. Hal ini bisa terjadi karena ada zat yang bersifat reduktor. Contohnya H2,Li,alumunium hibrida dan NaBH4. Adapun reduktor ini bersifat sebagai nukleofil atau spesi yang negative. Contoh pada reaksi hidrogenasi alkena Dimana etena di reduksi dengan hydrogen dengan katalisnya platina dan palladium-c maka ia akan menghasilkan etana, dimana bertambahnya ikatan C-H yang awalnya hidrogennya ada dua setelah di reduksi H nya bertambah menjadi 3. Reduksi alcohol Alcohol mudah di buat dari senyawa karbonil melalui reaksi reduksi, yakni terjadi penambahan atom hydrogen pada...